La interacció de ALDH1A3 amb ATP: noves evidències sobre la seva funció en càncer, diabetis i obesitat
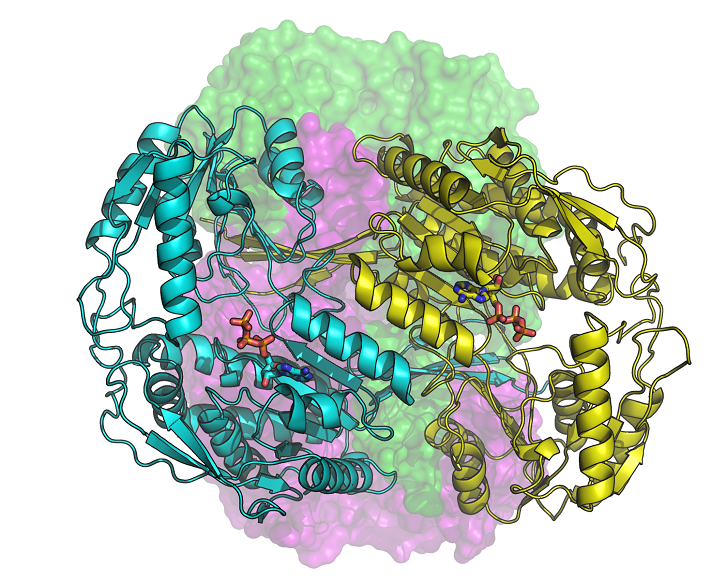
L’aldehid deshidrogenasa 1A3 (ALDH1A3) humana és un enzim que uneix ATP, a la vegada que és biomarcador de les cèl·lules iniciadores de tumors, responsables de la resistència a la quimioteràpia. Segons un estudi del Departament de Bioquímica i de Biologia Molecular de la UAB, en col·laboració amb el Sincrotró ALBA, el seu silenciament restableix la sensibilitat de les cèl·lules tumorals als agents quimioterapèutics.
Els enzims són proteïnes catalitzadores que acceleren reaccions biològiques específiques. L’aldehid deshidrogenasa 1A3 (ALDH1A3) humana pertany a un grup d’enzims especialitzats en l’oxidació dels aldehids als seus àcids carboxílics, amb la col·laboració del dinucleòtid de nicotinamida i adenina (NAD), que actua com a cofactor. Aquests enzims s’ocupen d’eliminar els aldehids, compostos químicament molt reactius i sovint tòxics, participant, entre altres, en la via metabòlica de l’alcohol, així com en el metabolisme hormonal. Són també actius en la defensa cel·lular front a drogues i fàrmacs, com aquells que o bé són aldehids o que actuen augmentant la producció de radicals lliures i la peroxidació de lípids. En particular, l’ALDH1A3 es troba en el citoplasma cel·lular i s’expressa de manera habitual en diferents òrgans i teixits, com les glàndules salivals, l’estómac o el ronyó. Una de les seves funcions fisiològiques és la producció d’àcid retinoic, derivat de la vitamina A, mitjançant el qual es regula l’expressió de múltiples gens que controlen, al seu torn, processos vitals com la proliferació i la diferenciació cel·lular. Existeixen nombrosos estudis que demostren que l’alteració de l’activitat enzimàtica de l’ALDH1A3 està associada a malalties com el càncer, la diabetis i l’obesitat.
L’ALDH1A3 és també un biomarcador de les cèl·lules mare del càncer, també anomenades cèl·lules iniciadores de tumors. Es creu que aquestes cèl·lules són en bona part les responsables de l’aparició de resistència a la quimioteràpia, així com de la recaiguda i la metàstasi en la malaltia cancerosa. En els darrers anys, l’ALDH1A3 ha esdevingut una nova diana terapèutica i, de fet, el seu silenciament restableix la sensibilitat de les cèl·lules tumorals als agents quimioterapèutics. Així doncs, el bloqueig de l’activitat ALDH1A3, a través d’inhibidors (molècules que s'uneixen a l'enzim i en disminueixen la seva activitat) farmacològics administrats conjuntament amb anticancerígens convencionals, podria contribuir a millorar la resposta terapèutica. Per aquest motiu, l’estudi de les relacions estructura-funció de l’ALDH1A3 pot obrir les portes al disseny racional de nous agents terapèutics.
A l’article publicat a la revista Communications Biology descrivim per primera vegada l’estructura molecular de tres configuracions de l’ALDH1A3, obtingudes mitjançant cristal·lografia de raigs X en la línia de llum XALOC del Sincrotró ALBA. Les noves estructures han permès conèixer amb precisió la posició dels àtoms de l’enzim i com s’uneix al seu cofactor NAD o a l’ATP, també conegut com “la moneda energética de la cèl·lula”.
De l’estudi en destaca el descobriment de la unió de la molècula d’ATP a un membre la superfamília ALDH. S’observa, a més, que l’ATP actua com a inhibidor reversible de l’ALDH1A3, pel que podria modular-ne l’activitat en canviar l’estat energètic de la cèl·lula. Per una altra banda, es coneix que els nivells intracel·lulars d’ATP són més elevats en cèl·lules tumorals i, especialment en aquelles que han esdevingut resistents a fàrmacs, que no pas en cèl·lules normals o sensibles a fàrmacs del mateix origen cel·lular. A més, l’ALDH1A3 és més abundant en cèl·lules canceroses, fet que pot afavorir la producció d’ATP. En canvi, la inhibició de l’enzim en cèl·lules canceroses condueix a una disminució significativa del consum de glucosa i a una reducció de la producció de lactat i ATP. Aquesta modulació de l’activitat ALDH1A3 per part l’ATP podria ser també rellevant en altres patologies, com la diabetis i l’obesitat.
En resum, els resultats derivats d’aquest treball ens permeten especular que l’estat energètic de la cèl·lula està associat a l’ALDH1A3 i al seu paper potencial en la reprogramació metabòlica provocada per malalties com el càncer, la diabetis i l’obesitat. A més, la disponibilitat de les noves estructures tridimensionals d’alta resolució afavorirà el disseny racional d’inhibidors contra ALDH1A3 i pot impulsar el descobriment de nous fàrmacs.
Aquest treball ha sigut realitzat pel Dr. Albert Castellví i la Dra. Raquel Pequerul, del grup de recerca del Departament de Bioquímica i Biologia Molecular de la UAB, liderat pels Drs. Jaume Farrés i Xavier Parés, en col·laboració amb la Dra. Judith Juanhuix del Sincrotró ALBA.
Referències
Castellví A, Pequerul R, Barracco V, Juanhuix J, Parés X, Farrés J. Structural and biochemical evidence that ATP inhibits the cancer biomarker human aldehyde dehydrogenase 1A3. Commun Biol. 2022 Apr 13;5(1):354. DOI: 10.1038/s42003-022-03311-1.


