El descubrimiento de un mecanismo de defensa contra fagos en Salmonella plantea nuevos retos para la aplicación de la terapia fágica
La terapia fágica, uso de virus que infectan a bacterias, se considera una estrategia prometedora para el tratamiento de las infecciones bacterianas. Sin embargo, se enfrenta al reto de que las bacterias pueden desarrollar mecanismos sofisticados para defenderse. Personal investigador de la UAB ha identificado un nuevo mecanismo de defensa en Salmonella adquirido por transferencia lateral en el intestino de pollos de engorde tratados con terapia fágica oral.
Investigadores del Grupo de Microbiología Molecular del Departamento de Genética y de Microbiología de la UAB, liderados por la Dra. Montserrat Llagostera, han publicado un estudio pionero que describe un nuevo mecanismo de defensa adquirido por transferencia lateral en Salmonella, que conduce a una disminución en la expresión de proteínas estructurales y de la lisis celular del bacteriófago UAB_Phi20, culminando en una infección abortiva.
La terapia fágica se ha convertido en los últimos años en una estrategia fundamental para tratar las infecciones bacterianas causadas por patógenos que han desarrollado resistencia múltiple a los antimicrobianos convencionales. Sin embargo, la coevolución bacteriófagos/bacterias ha dado lugar a la emergencia de una amplia variedad de estrategias bacterianas para contrarrestar la infección fágica, lo que representa un desafío significativo para la aplicación extensiva de la terapia fágica en la salud humana y animal. El estudio de estos mecanismos de defensa es fundamental para comprender la relación fago/bacteria y también para garantizar el uso seguro de la terapia fágica.
En este contexto, el trabajo que se ha publicado recientemente supone un estudio innovador al identificar el gen ibfA como un nuevo factor de defensa en Salmonella enterica serovar Typhimurium frente al fago virulento UAB_Phi20. El hallazgo es especialmente relevante porque dicho gen no está codificado en el genoma bacteriano, sino que ha sido identificado en un plásmido conjugativo del grupo IncI1α, adquirido por Salmonella por transferencia lateral en el intestino de pollos de engorde durante un tratamiento con terapia fágica oral.
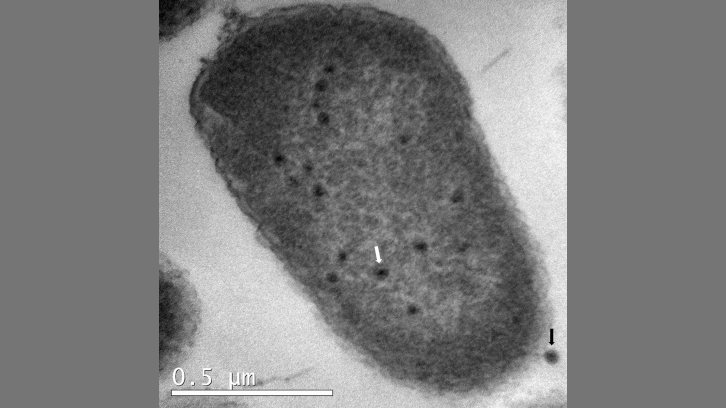
Utilizando un enfoque metodológico basado en microbiología molecular, técnicas microbiológicas convencionales, microscopía electrónica de transmisión (TEM) y bioinformática, se ha caracterizado la función del gen ibfA, que codifica una proteína con dos dominios tipo ATPasa y TO-PRIM. La expresión de IbfA reduce significativamente la infectividad y productividad del fago UAB_Phi20, evidenciado por la disminución de la eficiencia de plaqueo (EOP), la eficiencia de formación de centros infectivos (ECOI) y el tamaño de explosión fágica, sin observarse lisis celular evidente, aunque sí una menor viabilidad celular.
A nivel molecular, se ha observado que ibfA altera el proceso de transcripción del genoma del fago, favoreciendo la expresión de los genes tempranos del fago, como el antirrepresor ant, lo que provoca un desequilibrio entre las proteínas reguladoras Cro y C2. Este desequilibrio conduce a una reducción en la expresión de proteínas estructurales del fago y de la lisis celular, lo que finalmente resulta en una infección de tipo abortivo, efecto que podría hacerse extensivo a otros fagos tipo P22.
Además, a pesar del origen evolutivo incierto de ibfA, este gen se encuentra ampliamente distribuido tanto en cromosomas como en plásmidos de procariotas, lo que sugiere que podría ejercer funciones adicionales beneficiosas para las células bacterianas, más allá de la defensa frente a fagos.
Departamento de Genética y Microbiología
Universitat Autònoma de Barcelona
Referencias
López-Pérez, J.; Cortés, P.; Campoy, S.; Erill, I.; Llagostera, M. (2025). Deciphering the causes of ibfA-mediated abortive infection in the P22-like phage UAB_Phi20. International Journal of Molecular Sciences 26(10): 4918. https://doi.org/10.3390/ijms26104918


