Biocatalizadores de oro: avance en el campo de la química sintética
Investigadores en química computacional del Departamento de Química de la UAB han creado unas de las primeras metaloenzimas de oro, optimizando un camino de reacción en el cual dos complejos de oro trabajan juntos. En el estudio, realizado en colaboración con expertos de la Universidad de Basilea y publicado en Nature Catalysis, han combinado métodos de modelado molecular con técnicas experimentales para conseguirlos. Los nuevos biocatalizadores suponen un avance hacia una química sintética eficiente y respetuosa con el medio ambiente.
La naturaleza es una experta en el mundo de la química y, gracias a millones de años de evolución, el mundo biológico es un extraordinario conjunto de sistemas catalíticos llamados enzimas que transforman sustancias endógenas o exógenas en productos necesarios para el buen funcionamiento de los seres vivos. Estas enzimas presentan propiedades que envidiamos nosotros, los químicos, y muchos investigadores que se dedican a la transformación de la materia.
Las enzimas suelen convertir los reactivos en productos con rendimientos muy buenos, son muy selectivas en cuanto a las moléculas sobre las que actúan y muy específicas respecto a qué enlaces transforman. Además, trabajan en agua, un disolvente crucial para una química ecológicamente neutra, pero todavía difícil de controlar por los químicos de síntesis. No es extraño que, en las últimas décadas, químicos, bioquímicos y biotecnólogos hayan intentado obtener el máximo beneficio del uso y la manipulación de enzimas.
Los avances durante las últimas décadas en técnicas de biología estructural han abierto la puerta al desarrollo de enzimas de novo que tienen estructuras moleculares y o reactividades ausentes en la naturaleza. En este campo, la modelización molecular proporciona información relevante gracias a los numerosos modelos teóricos disponibles y la constante mejora de la capacidad de cálculo de los ordenadores. Hoy en día, son herramientas inestimables para comprender el funcionamiento de las enzimas y predecir qué modificaciones pueden hacerlas más eficientes.
Muchas enzimas naturales funcionan incorporando sistemas metálicos en su propio lugar de reacción. Por lo tanto, este concepto se copió para el desarrollo de nuevos biocatalizadores. Una de las estrategias más exitosas consiste en introducir catalizadores metálicos "pequeños" derivados de la química de coordinación en proteínas huéspedes compatibles. Este enfoque ya ha permitido crear metaloenzimas que incorporen metales como el paladio, el platino o el rodio, de los que la naturaleza nunca ha hecho uso.
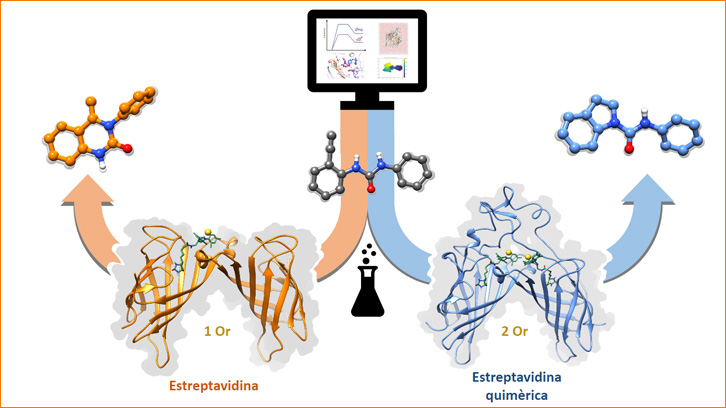
El trabajo realizado en colaboración entre el grupo del profesor Ward de la Universidad de Basilea (Suiza) y Jean-Didier Maréchal, Agustí Lledós y Laura Tiessler, investigadores y estudiante de doctorado, respectivamente, del Departamento de Química de la UAB, muestra una serie de avances en el desarrollo de enzimas artificiales, en los que se combinan métodos de modelado molecular con una serie de técnicas experimentales para producir una de las primeras metaloenzimas de oro, optimizando un camino de reacción en el que dos átomos complejos de oro trabajan juntamente.
El oro es un metal considerado durante mucho de tiempo inerte en términos catalíticos y ausente en el repertorio de enzimas naturales. Poco presente hasta recientemente en el campo de la química biológica, el oro y algunos de sus complejos de coordinación han mostrado diferentes reactividades únicas, como la hidroaminación de triple enlace entre dos carbonos. El equipo que ha realizado este estudio ha sido capaz de incorporar catalizadores de oro sintéticos en el lugar de unión de la estreptavidina, la proteína de predilección del laboratorio suizo, y controlar la actividad de la enzima mediante el estudio teórico y los experimentos de evolución dirigida.
La característica más excepcional de este trabajo es la capacidad de controlar el número de catalizadores implicados en el lugar catalítico, uno o dos. Esto permite diferentes mecanismos de reacción que conducen a productos diferentes. En particular, el estudio consigue caracterizar mutantes de la proteína que favorecen la hidroaminación del tipo anti-markonikov, que conduce a un producto cíclico con cinco miembros altamente minoritario por la reacción en un sistema no proteico.
Este estudio multidisciplinario que combina teoría y experimentación muestra el potencial de estos enfoques para aumentar el catálogo de enzimas útiles para conseguir una química sintética eficiente y respetuosa con el medio ambiente.
Departamento de Química
Universidad Autónoma de Barcelona
Referencias
Christoffel, F., Igareta, N.V., Pellizzoni, M.M. et al. Design and evolution of chimeric streptavidin for protein-enabled dual gold catalysis. Nato Catal (2021). https://www.nature.com/articles/s41929-021-00651-9


